ことの始まり
国立障害者リハビリテーションセンター(国リハ)の病院を訪れた網膜色素変性症(RP)の患者68名から提供していただいた血液からゲノムDNAを抽出し、ロドプシンをはじめ各種既知原因遺伝子のエクソン部分の塩基配列を決定しましたが、病因変異は見つかりませんでした(K07-1)。まだ未知の原因遺伝子があるのだろうと思い始めた頃、2009年に、病院の仲泊聡眼科部長からレジデントの岩波将輝博士を紹介されました。
岩波氏はRPの原因遺伝子探索をやってみたいということ、しかもこのころ海外で報告されたEYSという遺伝子を標的にしてみたいと話されました。国立遺伝学研究所で ショウジョウバエの光受容細胞の研究で学位を取られたとのことで、DNAの取り扱いには慣れておられるので、すぐ実験を始めることができました。ちなみに、EYSはショウジョウバエの眼の光受容細胞の発生や形態形成に関与するeyes shut/spacemaker (eys)のホモログです。
経緯
実験を行う上で最大の問題は、EYSの遺伝子座位が巨大であることです。2Mbの領域に43個のエクソンがあり、mRNAは約10,000塩基と途方もない大きさです。シーケンスを行う立場からすれば、これを標的として選ぶ気にはなりません。しかし、遺伝子が大きければ、それだけ変異が入る確率も高くなるので、その意味では病因変異が見つかる可能性も大きいことが期待されました。
翻訳領域を含む40個のエクソンを増幅するために76本のプライマーと両方向からシーケンスするために90本のプライマーを準備し、68名の患者のゲノムDNAを用いてサンガー法で塩基配列を決定し始めました。2011年1月7日に岩波氏が26番目のエキソンに一塩基挿入(c.4957dupA、p.(Ser1653Lysfs))が見つかったと興奮してやってきました。その後、同じ変異を持つ患者が次々と見つかり、これがRPの原因変異である可能性が高くなりました。
結果
68名の患者のEYS翻訳領域をすべてシーケンスした結果、アミノ酸残基の変化を伴う10箇所のヌクレオチド変異が見つかりました。その中で、p.(Ser1653Lysfs) (M1)、p.(Tyr2935*) (M2)、p.(Gly843Glu) (M3)という3つの変異が複数の患者で認められました。M1とM2はそれぞれフレームシフトとナンセンス変異による短縮型変異なのでタンパク質のC端側が欠けることになり、病因変異であると判定しました。ミスセンス変異であるM3については、対照群にも見出されたのでSNPsの可能性もあり、この論文では病因変異であるとは断定できませんでした。ただ、M3の頻度は患者の方が統計的に有意に高いので、今後の検討課題としました。
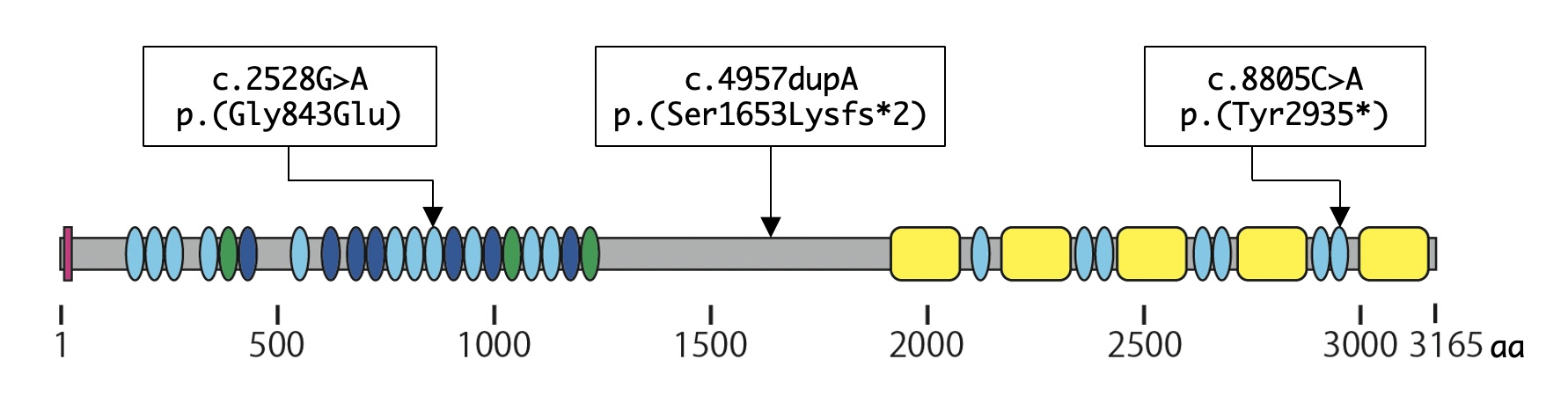
最終的に、40個のエクソンとエクソンの前後約200bp、患者1名につき総計約27kbpの塩基配列を決定したことになります。その結果、この領域にあるすべてのSNPsを決めることができ、これを用いてハプロタイプの解析も可能となりました。ただ、領域が2Mbもあるので、多くのハプロタイプブロックがあり、ロドプシンの場合のように、全領域を一つのハプロタイプとして取り扱うことはできません。したがって、ハプロタイプブロックごとの解析となります。その結果、M1、M2、M3のいずれも特定のハプロタイプ上に存在することがわかりました。しかも、当時わかっていた範囲では、日本人にのみ見られる変異でしたので、いずれも日本人患者に特徴的な創始者変異であると考えられます。
主要病因変異の存在が明らかになったところで、次に問題となるのは、各変異と表現型との関係です。RPは進行性の疾患であり、今回ご協力いただいた患者は、国リハ病院を定期的に訪れているので、カルテを見れば病状の進行の様子がわかります。そこで各患者で、視力の経年変化が遺伝型と相関があるかどうかを調べたところ、両アレルに短縮型変異を有している患者では、視力の著しい経年低下が認められました。この結果は、遺伝子診断によって予後の推測ができる可能性を示唆するものですが、EYSの機能や変性のメカニズムがまだわからないので、他の要因もありえます。
余談
68名のRP患者のゲノムDNAをすでに持っていたこと、ロドプシン遺伝子のゲノム解析の経験があったこと、そして岩波氏と出会ったといった幸運が重なり、EYSが日本人RPの主要原因遺伝子であることを見いだすことができました。日本人患者でEYSの変異を見つけたのは、我々が最初であろうと思っていたところ、ほぼ同じ時期に浜松医大のグループが、類似した内容の論文(Hosono et al., 2012)を発表しました。我々の論文は、2011年11月10日に投稿し、2012年1月3日受理され、2012年2月3日に出版されました。一方、浜松医大の論文は、2011年9月9日に投稿、2011年12月30日に受理、2012年2月17日に出版されました。ほぼ同時といってよいでしょう。この分野では、このようなことはよくあることで、最初にEYSがRPの原因遺伝子であることを見つけた論文も二つのグループが2008年にほぼ同時に報告しました。
我々と浜松医大の論文の違いは、①患者数が浜松医大の方が100名と多く、さらに36名の韓国人患者についても調べている、②浜松医大はM3をSNPとして扱っている、③我々はハプロタイプ解析を行い、M1とM2は創始者変異であることを示した、④我々は配列データだけでなく臨床データも記載し、遺伝型と表現型の相関関係の可能性を示唆したことです。いずれにしても患者に重複はない(と思われる)ので、両者のデータを合わせることによって、EYSの変異スペクトラムがより明らかになったといえます。
疑問点
日本人網膜色素変性症の主要原因遺伝子を明らかにすることができましたが、下記のような多くの疑問が出てきました。Q1からQ3については、さらに研究を進め、いくつか答えを得ることができました(K18-1、K19-1)。もっとも根本的な問題である「 EYSの機能」については、その後、他所からいくつかの論文が出てきました。また、他の疑問についても関連する研究が行われているので、別項でそれぞれ個別に進展状況を紹介することにします。
Q1 フレームシフト変異M1とナンセンス変異M2の転写産物はどうなるのか?
Q2 M3は病因変異か?
Q3 単一ヘテロ接合型のもう一方のアレルの変異は何か?
Q4 創始者変異であるM1、 M2、M3は、いつ頃生成したのか?
Q5 EYSの変異による変性メカニズムは?
Q6 遺伝型と表現型の相関はあるのか?
Q7 EYSの機能はなんなのか?
Q8 EYSのアイソフォームの役割は?
Q9 げっ歯類になぜEYSはないのか?
Q10 どのような治療法が考えられるか?
被引用文献
本論文は、日本人のRP患者がEYSに病因変異を有することをはじめて明らかにしたということで、浜松医大の論文とともに、以後、EYSに関する多くの論文で引用されることになりました。Invest. Ophthalmol. Vis. Sci.のホームページで、2015年以降のMetricsを見ると、2021年7月22日の時点で、PDFダウンロード数682、被引用文件数46とかなり見られていることがわかります。
PubMedに掲載の被引用文献について、年代順に、国、研究機関、雑誌名、論文タイトル、被引用事項をリストにまとめてみました。ほとんどの論文は、我々の論文を日本人のarRP患者のEYS遺伝子変異による有病率が高いということを示した論文として引用しています。
日本では、京都大(R14021)、理研(R15043)、九州大(R19011)が、次世代シーケンサーによるエクソームシーケンシングにより、EYSが日本人RPの主要原因遺伝子であることを追認しました。興味深いのは、M1は数は少ないが韓国(R15045、R19022)や中国(R16011)でも見出されていることです。
なお、二つの論文(R19017、R20037)は、我々の論文とは無関係の事項で、誤って引用されています。このような誤引用は、論文をよく読んでいないせいと思われ、データの信頼性をも損ねるものです。